- EXPLOSIVES (SUBSTANCES)
- EXPLOSIVES (SUBSTANCES)On désigne sous le nom de substances explosives des composés définis ou des mélanges de corps capables, par des décompositions chimiques, de libérer en un temps très court leur énergie potentielle, cette libération s’accompagnant le plus souvent du dégagement d’un important volume de gaz, qui, portés à une température élevée, exercent, sur les éléments ambiants, une pression extrêmement forte.L’origine de l’énergie calorifique de la réaction explosive permet de distinguer:– les substances explosives endothermiques , dont les molécules sont formées à partir de leurs éléments avec absorption de chaleur. Le dégagement de chaleur est alors dû à la décomposition de la substance en ses éléments, mais, bien entendu, il ne suffit pas qu’une molécule soit endothermique pour être explosive, car l’énergie libérée par sa décomposition peut être insuffisante pour provoquer celle des molécules voisines, les liaisons intramoléculaires étant trop fortes ou trop nombreuses.– les substances explosives exothermiques , dont les molécules sont formées à partir de leurs éléments avec dégagement de chaleur. Dans ce cas, l’énergie fournie par l’explosion provient de la destruction de l’édifice moléculaire, qui s’accompagne de réactions exothermiques entre certains groupes ou certains éléments des molécules. Il s’agit notamment, le plus souvent, de phénomènes de combustion interne entre des groupements porteurs d’oxygène – nitrés (face=F0019 漣 2), nitratés (face=F0019 漣 O 漣 2), etc. – et des éléments facilement oxydables, comme le carbone et l’hydrogène.Presque toutes les substances explosives appartiennent à ce second groupe, auquel se rattachent naturellement les mélanges constitués d’un ou de plusieurs comburants (nitrates, chlorates, perchlorates, peroxydes, oxygène liquide...) et d’un ou de plusieurs combustibles (charbon, hydrocarbures, dérivés nitrés...), qui peuvent avoir isolément des propriétés explosives.Les phénomènes mécaniques, sonores ou lumineux, qui accompagnent la décomposition des substances explosives et ont, de tout temps, frappé l’imagination, donnent à penser à beaucoup de profanes que celles-ci renferment de grandes quantités d’énergie, alors qu’en fait il n’en est rien (du point de vue de la quantité de chaleur dégagée, un kilogramme d’essence correspond à la décomposition de 7,5 kg de nitroglycérine). Les molécules explosives présentent seulement l’intérêt de permettre la réalisation de grandes puissances instantanées et de ne pas avoir besoin d’emprunter à l’atmosphère extérieure l’oxygène nécessaire à leur combustion.Elles ne sont, en outre, ni particulièrement instables ni caractérisées par une faible valeur de «l’énergie d’activation», c’est-à-dire de l’énergie qu’il faut fournir à une molécule pour qu’elle puisse entrer en réaction, mais, dans le cas de ces molécules, il y a transfert avec une rapidité plus ou moins grande de l’énergie d’activation entre les produits de décomposition et les molécules non encore décomposées.1. Des mélanges chinois aux propergolsBien que certains mélanges de salpêtre, soufre et charbon aient été certainement connus des Chinois dès les premiers siècles de l’ère chrétienne et que les Grecs aient, vers le VIIe siècle après J.-C., inauguré l’emploi des feux grégeois, mélanges complexes à base de salpêtre, de soufre, de bitume, de pétrole, etc., ni les uns ni les autres ne paraissent avoir eu conscience de l’énergie particulière contenue dans la poudre noire, la plus ancienne de toutes les substances explosives. En revanche, les Arabes, qui avaient de fréquentes relations commerciales avec les Chinois, semblent avoir su fabriquer la poudre noire dès le XIIIe siècle et l’avoir utilisée pour lancer à grande distance des projectiles d’armes portatives. C’est seulement au début du XIVe siècle que cette poudre fait son apparition en Europe – sa redécouverte est souvent attribuée au moine franciscain allemand Berthold Schwartz – d’abord comme poudre à canon; beaucoup plus tard (Hongrie, 1630; Angleterre, 1670) elle sera utilisée dans les exploitations minières.Pendant les guerres de la Révolution, Claude Louis Berthollet essaie sans succès de substituer le chlorate de potassium au salpêtre dans la poudre noire. Aussi, pendant plus de deux siècles, jusqu’aux découvertes du coton poudre (par Christian Friedrich Schoenbein à Bâle en 1845) et de la nitroglycérine (par le chimiste italien Sobrero en 1847), la poudre noire demeure-t-elle la seule substance explosive. Malgré les propriétés explosives reconnues aux composés précédents, les difficultés et les dangers de leur fabrication et surtout de leur emploi – les tentatives notamment pour charger le coton poudre dans les bouches à feu se soldent par des accidents particulièrement graves – vont en faire pratiquement différer encore les utilisations pendant une vingtaine d’années.C’est le Suédois Alfred Nobel qui, en réussissant à faire absorber la nitroglycérine d’abord par une terre d’infusoires, le kieselguhr, puis par de la nitrocellulose, et en mettant au point le premier détonateur au fulminate de mercure pour exciter la détonation de ces compositions, ouvre vraiment vers 1870, avec les dynamites, l’ère des applications des explosifs dans l’industrie. En 1884, le Belge Favier suggère l’emploi dans les travaux miniers (et notamment dans les mines grisouteuses) d’explosifs au nitrate d’ammonium, dont la température d’explosion est peu élevée. En 1897, l’Anglais Street rend utilisables les chlorates alcalins dans la fabrication des explosifs en atténuant leur sensibilité au frottement au moyen d’huile de ricin, cependant que l’Allemand Karl Ritter Linde invente (1895) les explosifs à l’oxygène liquide utilisés en 1899 pour le percement du Simplon.Dans le domaine des explosifs militaires, la fin du XIXe siècle voit préconiser pour le chargement des projectiles, en France, l’acide picrique ou trinitrophénol (Eugène Turpin, 1885) et, en Allemagne, la tolite ou trinitrotoluène (Emile Häussermann, en 1891). Entre les deux guerres mondiales, deux explosifs – l’hexogène, ou dérivé trinitré de l’hexaméthylènetétramine, et la penthrite, ou tétranitrate de pentaérythrite –, fabriqués à partir d’une matière première organique entièrement synthétique, le méthanal, prennent place parmi les substances explosives les plus brisantes. À partir des années cinquante, la recherche d’explosifs à plus grande vitesse de détonation ou admettant des températures d’emploi plus élevées allait souligner l’intérêt d’une nouvelle nitramine, l’octogène ou tétraméthylènetétranitramine.En 1884, l’ingénieur français Paul Vieille met au point la première poudre sans fumée en gélatinisant des nitrocelluloses par un mélange d’éther et d’alcool. Après élimination du solvant, la matière colloïdale brûle par couches parallèles et peut remplacer la poudre noire dans les canons. Cherchant à substituer, dans le Celluloïd, le camphre par la nitroglycérine, partiellement, puis totalement, A. Nobel obtient (1888) une substance cornée, qui peut être mise sous la forme de grains très résistants utilisables dans les armes. Peu avant la Première Guerre mondiale (1910) apparaissent, en Allemagne, des poudres colloïdales à la nitroglycérine sans dissolvant volatil. Des poudres analogues se développent progressivement dans la plupart des pays, entre les deux guerres mondiales. Pour en améliorer les performances ou les qualités, elles reçoivent des additions plus ou moins importantes de composés chimiques divers (dérivés nitrés, nitrates, urées substituées, métaux pulvérulents, etc.). L’autopropulsion, dont les possibilités ont été mises en évidence par les roquettes, au cours de la Seconde Guerre mondiale, prend, après celle-ci, une extension considérable avec l’introduction d’autres techniques de fabrication (poudres moulées) et de compositions propulsives (poudres composites à base d’un oxydant dispersé dans une matière thermoplastique, thermodurcissable ou thermopolymérisable servant de combustible) permettant de réaliser des missiles de grandes dimensions, pour des applications militaires ou civiles (industrie aérospatiale).2. Déflagration et détonationLa vitesse avec laquelle s’opère le transfert d’énergie d’activation entre produits de décomposition et molécules non décomposées, donc la vitesse avec laquelle une substance se décompose, amène à distinguer:– Les substances dont la vitesse de décomposition est relativement faible et qui, seules employées dans la propulsion des projectiles et des roquettes, sont en France communément appelées «poudres», parce qu’elles ont progressivement remplacé dans presque tous ses usages d’agent propulsif la poudre noire, qui se présentait le plus souvent sous forme pulvérulente. La décomposition plus ou moins vive de ces substances porte le nom de combustion ou de déflagration .– Les substances dont la vitesse de décomposition est extrêmement élevée et qui sont désignées sous le nom d’«explosifs détonants, ou brisants», leur décomposition appelée détonation se propageant dans la masse entière de la substance sous l’apparence d’une onde de choc, qui s’accompagne d’effets mécaniques destructeurs. Les explosifs détonants, ou plus simplement les explosifs, peuvent être eux-mêmes divisés en explosifs primaires (ou explosifs d’amorçage), qui détonent presque toujours sous l’effet d’un choc, d’une étincelle, d’une flamme ou de toute autre source de chaleur de valeur convenable, et explosifs secondaires (ou de chargement), qui exigent le plus souvent pour détoner l’excitation d’un dispositif, le détonateur, renfermant un explosif primaire.Presque toutes les substances explosives peuvent être amenées à déflagrer et à détoner, mais, entre les deux phénomènes, il existe des différences importantes qui méritent d’être soulignées.Lorsqu’une substance explosive déflagre , la surface en ignition progresse à une vitesse, qui varie avec les conditions de l’essai, notamment avec la pression dans l’espace ambiant, de quelques millimètres à quelques mètres par seconde au maximum sans phénomène mécanique et sans bruit notable. Les gaz et les fumées qui prennent naissance se déplacent en sens contraire de la surface de décomposition de la substance. La flamme se dirige donc vers la partie consumée de la poudre, et la partie intacte de celle-ci reçoit une impulsion dans le sens même de la propagation de la surface en ignition.Lorsqu’une substance explosive détone , la surface de décomposition progresse à une vitesse constante atteignant plusieurs kilomètres par seconde et cette propagation s’accompagne d’un claquement violent et d’une forte élévation de la pression. Les gaz et les fumées se déplacent dans le même sens que la surface de décomposition, aussi la partie de la substance qui n’a pas encore détoné ne reçoit-elle aucune impulsion.Pour provoquer la décomposition d’une substance explosive, il est nécessaire de lui apporter une certaine quantité d’énergie d’activation, qui peut revêtir différentes formes, dont deux particulièrement importantes: l’échauffement et le choc mécanique.À température relativement basse, l’énergie fournie par une source de chaleur se répartit statistiquement entre les différentes molécules et, même si certaines de celles-ci se décomposent, la chaleur dégagée se dissipe par conductivité et par rayonnement. À température plus élevée, non seulement le nombre de molécules qui se décomposent devient plus important, mais les calories dégagées ne sont plus éliminées assez rapidement et la température de la substance explosive tend alors à dépasser de plus en plus celle de la source de chaleur. Finalement, la réaction de décomposition s’emballe et la substance explosive déflagre.La plupart des substances explosives se décomposent sous l’effet de chocs mécaniques suffisamment violents, soit que le choc brise les forces qui maintiennent sous tension les molécules explosives, soit qu’il engendre au point d’impact une grande quantité de chaleur, la température élevée qui en résulte étant la cause de la déflagration. D’une manière générale, la sensibilité au choc des substances explosives augmente quand on leur donne une forme plus compacte ou plus rigide de façon à localiser les effets mécaniques et l’échauffement, ou quand on les mélange à des compositions étrangères, ce qui accroît les frottements et les chocs locaux.3. ClassificationSi la décomposition d’une substance explosive a toujours pour origine une excitation plus ou moins énergique: élévation de température, frottement, choc, amorçage par un détonateur..., cette décomposition peut changer d’allure avec la nature de l’excitation ou la quantité de matière mise en œuvre. Aussi le classement d’une substance parmi les poudres ou les explosifs est-il essentiellement fondé sur l’utilisation normale ou la plus fréquente qu’on en fait. Du point de vue des applications, il est dès lors possible de distinguer:– les composés définis ou les compositions dont l’emploi met à profit le phénomène de détonation dans le dessein de produire un effet destructeur (explosifs de chargement), ou bien de relayer ou d’amorcer la détonation (relais ou détonateur) dans un explosif secondaire;– les composés définis ou les compositions dont l’emploi met à profit le phénomène de déflagration dans l’intention soit d’obtenir des effets balistiques ou mécaniques (agents propulsifs), soit de transmettre la combustion (mèches, amorces), soit encore de réaliser des effets visuels ou auditifs (artifices incendiaires, éclairants, sonores).Si l’on considère les substances explosives du point de vue de leur structure chimique, on peut les diviser en corps définis renfermant, le plus souvent juxtaposés dans la molécule, des éléments comburants ou combustibles: c’est le cas de la majorité des explosifs militaires modernes, explosifs nitrés pour la plupart; et en mélanges de substances, explosives ou non par elles-mêmes, dont les unes apportent un excès de comburant (oxydants) et les autres un excès de combustible: c’est le cas de la majorité des explosifs de mine et des compositions déflagrantes, comme la poudre noire, et même – si l’on fait abstraction de leur structure physique particulière – comme les poudres modernes sans fumée (matières colloïdales homogènes) et les poudres composites (matières plastiques fortement chargées d’un oxydant minéral).Compte tenu de ces faits, on voit que toutes les substances explosives peuvent en gros s’insérer dans le classement simple indiqué dans le tableau 1.4. FabricationComme l’énergie libérée par la décomposition de la plupart des substances explosives provient de la combustion du carbone et de l’hydrogène, la fabrication de ces substances consistera en général soit à fixer sur une molécule organique des groupements contenant de l’oxygène et pouvant le libérer, lors de l’explosion, pour assurer la combustion, soit à préparer des mélanges intimes de corps combustibles (charbon, paraffine, dérivés nitrés organiques, matières plastiques...) renfermant une quantité d’oxygène insuffisante pour leur combustion totale, avec des corps comburants qui apportent l’oxygène nécessaire à celle-ci (nitroglycérine, nitrate de sodium, de potassium ou d’ammonium, chlorate de sodium ou de potassium, perchlorate d’ammonium ou de potassium, etc.).Explosifs simplesHormis quelques applications militaires, ces explosifs trouvent surtout un emploi dans des mélanges destinés à l’exploitation de mines ou de carrières, ou au chargement de certaines munitions, ainsi que dans les poudres colloïdales ou composites.Esters nitriques. Ces explosifs résultent de l’action de l’acide nitrique (fréquemment additionné d’acide sulfurique) sur un alcool (ou plus généralement un polyalcool), sur la cellulose ou sur d’autres hydrates de carbone. Parmi les plus connus on peut citer: les nitrocelluloses, obtenues en nitrant de la cellulose purifiée de coton (linters) ou de bois par des mélanges sulfonitriques de concentration variable suivant le taux d’azote recherché; la nitroglycérine, le nitroglycol et le dinitrate de diéthylèneglycol, que l’on prépare en faisant agir un mélange sulfonitrique convenable sur la glycérine, le glycol ou le diéthylèneglycol; la penthrite, qui s’obtient en traitant par l’acide nitrique concentré la pentaérythrite (tétra-alcool).Dérivés nitrés. Ces explosifs correspondent au remplacement d’un ou de plusieurs atomes d’hydrogène par un (ou plusieurs) groupement nitré (face=F0019 漣 2). Contrairement à ce qui se passe dans le cas des esters nitriques, l’azote de ces groupements est directement lié à l’élément qui a perdu l’hydrogène (le carbone, dans les dérivés nitrés des hydrocarbures) et non séparé de celui-ci par un atome d’oxygène. La nitration, dans des conditions de température convenables, s’opère le plus souvent au moyen de mélanges sulfonitriques, dont on choisit la force en fonction du nombre de groupes 2 à introduire dans une même molécule. On peut mentionner, parmi les plus connus, les dérivés nitrés des hydrocarbures (azote directement lié au carbone), le dinitrotoluène, le trinitrotoluène ou tolite, les nitronaphtalines; des phénols (azote directement lié au carbone), le trinitrophénol ou acide picrique ou mélinite, le trinitrométacrésol ou crésylite, le trinitrorésorcinol ou acide styphnique; des amines aromatiques (nitration sur le cycle aromatique; azote directement lié au carbone), la trinitraniline, la tétranitraniline, l’hexanitrodiphénylamine; des groupes aminés (nitramines dans lesquelles un atome d’hydrogène lié à un atome d’azote trivalent est remplacé par un groupe nitré, azote directement lié à l’azote), le tétryl ou trinitro-2,4,6-phénylméthylnitramine (qui se rattache aux dérivés précédents par trois sur quatre de ses groupes nitrés), la nitroguanidine, la cyclotriméthylènetrinitramine ou cyclonite ou hexogène (nitration au moyen d’acide concentré de l’hexaméthylènetétramine) et la tétraméthylènetétranitramine ou homocyclonite ou octogène.Explosifs d’amorçage . Bien qu’il ne s’agisse pas de substances d’une même famille chimique, on a l’habitude de les regrouper dans une classe spéciale, en les séparant nettement des autres explosifs simples. Appartiennent à cette classe: le fulminate de mercure (dérivé de l’acide fulminique où le carbone serait bivalent et que l’on n’a pu isoler), l’azoture de plomb, le trinitrorésorcinate de plomb ou styphnate de plomb et le guanylnitrosaminoguanyltétrazène ou tétrazène, explosif entièrement organique contrairement aux trois premiers.Mélanges explosifsEn dehors des compositions réalisées à des fins surtout militaires, pour faciliter certains chargements comprimés ou fondus (pentolite, hexolite, penthrite paraffinée...), les divers mélanges explosifs peuvent être classés d’après la nature de leur comburant ou d’après certaines des qualités qui conditionnent leur possibilité d’emploi et dépendent souvent, en grande partie, des caractéristiques de ce comburant. La préparation de ces mélanges fait appel à des opérations et à des appareils qui varient avec les propriétés physiques des constituants et avec les qualités recherchées pour les compositions explosives. Dans certains cas, les ingrédients sont broyés et séchés avant mélange et granulation finale. Dans d’autres cas, ils sont malaxés ou pétris et parfois passés à la boudineuse pour mise en forme. Parfois même quelques constituants doivent être fondus avant d’être introduits dans les appareils. La composition chimique des principaux mélanges explosifs est donnée au tableau 2.Les dynamites sont des explosifs imaginés par Nobel et dont le constituant essentiel est la nitroglycérine. Parmi les dynamites, on a l’habitude de distinguer celles où la nitroglycérine n’est pas gélatinisée, son support – ou, comme l’on dit, la base – pouvant être lui-même actif ou inactif: dynamite guhr (dont la base est le kieselguhr), dynamite mixte (dont la base est un nitrate alcalin); et celles où la nitroglycérine est gélatinisée, le support du gel étant alors le coton azotique (nitrocellulose à taux d’azote relativement faible, variable entre 11,1 et 12,5 pour 100), gélatines explosives (renfermant uniquement de la nitroglycérine, une quantité importante de constituants additionnels combustibles et comburants, dont parfois certains peuvent absorber de la nitroglycérine).Préparés par la trituration de mélanges de nitrates d’ammonium et de divers combustibles – qui sont fréquemment des dérivés nitrés (dinitrobenzène, dinitronaphtalène, tolite...) – avec parfois additions d’aluminium (ammonals), les explosifs au nitrate d’ammonium, «explosifs nitratés», craignent l’humidité, mais présentent l’avantage d’être peu sensibles aux chocs violents, au frottement et même au feu.Les explosifs chloratés et perchloratés font appel à l’oxygène des chlorates de potassium et de sodium, ou des perchlorates de potassium et surtout d’ammonium. En raison de la sensibilité de ces produits aux actions mécaniques, leur emploi pratique date de l’enrobage, imaginé par le chimiste anglais Street, des grains d’oxydant dans une couche de liquide huileux (huile de ricin, etc.).Des mélanges d’explosifs à l’oxygène liquide sont réalisés au moment de l’emploi en trempant dans de l’oxygène liquide des cartouches de divers combustibles (sciure de bois, liège, tourbe, noir de fumée).Compositions pyrotechniquesAlors qu’il y a moins d’un siècle la pyrotechnie englobait l’ensemble des connaissances et des procédés de fabrication relatifs à la poudre, aux mélanges explosifs et aux compositions donnant par déflagration des effets lumineux, calorifiques, fumigènes, sonores ou mécaniques, mis à profit par la technique militaire, l’industrie, l’agriculture ou pour les fêtes et les réjouissances, on tend de plus en plus à ne comprendre sous ce terme que la «science» des artifices destinés au chargement d’engins ou de dispositifs éclairants (dont certains pour des prises de vue de nuit et parfois de jour), traçants (pour matérialiser les trajectoires), de signalisation, incendiaires, fumigènes, d’exercice (tabl. 3). On a en outre pris l’habitude de ranger comme appartenant à la pyrotechnie tout ce qui concerne les mélanges et les artifices utilisés pour amener à déflagrer (amorces, mèches...) ou à détoner (cordeaux, détonateurs...) les charges de poudres ou d’explosifs, en raison de la similitude de certaines techniques auxquelles on fait appel pour ces différentes confections. L’utilisation fréquente des mêmes mélanges dans plusieurs types d’artifices ou d’engins amène parfois à les classer d’après les caractères de leur décomposition et à considérer ceux qui donnent des flammes (ou des fumées) blanches ou colorées, ceux qui ne dégagent pas ou presque pas de gaz (thermites incendiaires...), ceux qui empruntent au milieu extérieur (air, eau) l’oxygène nécessaire à leur combustion (essence gélifiée par du palmitate de sodium, connue sous le nom de napalm), mais il est plus simple, en général, d’examiner les compositions pyrotechniques du point de vue de leurs constituants et du rôle spécifique de ceux-ci. On est ainsi conduit à distinguer:– les oxydants , dont le choix, malgré certaines exigences relatives en particulier à leur stabilité thermique et à leur résistance à l’humidité, est très large: nitrates (de potassium, de sodium, de baryum...), chlorates (de potassium, de baryum...), perchlorates (de potassium), peroxydes (de baryum, de strontium), oxydes (de fer, de manganèse, de plomb...), etc.– les combustibles , jouant parfois un rôle de liant, qui doivent s’oxyder facilement au contact de l’oxydant retenu, tout en restant convenablement stables dans le domaine d’emploi (température et humidité) prévu. On fait appel à des métaux (aluminium, fer, magnésium, zinc...), à des éléments non métalliques (carbone, phosphore, soufre...), à des sulfures (d’antimoine...), à des siliciures (de calcium...), à des hydrocarbures aliphatiques, cycliques ou à leur mélange (pétrole, essence, benzène...), à des hydrates de carbone (amidon, lactose...), etc.– les adjuvants mécaniques , de nature très variable, qui peuvent être des liants (bakélite, gomme, laque...), des flegmatisants, c’est-à-dire des produits destinés à diminuer la sensibilité des compositions (paraffine, stéarine, oxyde de magnésium...), des stabilisants...– les adjuvants balistiques , qui accélèrent ou freinent la combustion.Poudres colloïdalesAboutissement des recherches entreprises sur les possibilités d’utilisation du coton poudre comme agent propulsif à la place de la poudre noire, toutes les poudres colloïdales, communément appelées «poudres sans fumée», renferment de la nitrocellulose ou le plus souvent un mélange de nitrocelluloses à taux d’azote plus ou moins élevé, dont la gélatinisation résulte d’une dissolution partielle ou totale soit dans un solvant (ou un mélange de solvants) volatil, que l’on élimine ensuite plus ou moins complètement de la poudre pour faire de celle-ci une véritable solution solide, soit dans un liquide (ou un mélange de liquides) peu volatil, généralement un nitrate organique, qui reste incorporé à la poudre, la gélatinisation étant généralement activée par un traitement physique, le plus souvent à chaud (tabl. 4).Suivant les qualités recherchées pour la poudre, on est conduit à faire varier la nature et l’importance des autres substances (amines, urées substituées, uréthannes, éthers-sels, dérivés nitrés, etc., agissant comme stabilisants chimiques, plastifiants, gélatinisants, modificateurs énergétiques...) introduites dans celle-ci, le procédé de fabrication ayant de plus une influence non négligeable sur le pourcentage des divers constituants dans la poudre terminée. Le nombre des constituants essentiels («bases») de cette dernière, c’est-à-dire ceux qui y figurent avec un taux élevé (supérieur ou au moins égal à 10 p. 100 par exemple), amène à distinguer les poudres à simple, double ou multiple base.Les poudres à simple base sont formées presque exclusivement de nitrocelluloses et fabriquées avec un solvant volatil dans lequel une partie au moins des nitrocelluloses est soluble. Ces poudres conservent un taux de solvant résiduel d’autant plus élevé (jusqu’à quelques centièmes) que leur épaisseur finale est plus grande. Leur type est la poudre B, découverte par Vieille, qui renferme un mélange de coton poudre no 1 (nitrocellulose à taux d’azote supérieur à 13 p. 100) insoluble et de coton poudre no 2 (nitrocellulose à taux d’azote variant entre 11,5 et 12,5 p. 100) soluble dans un mélange d’éther et d’alcool, et qui est obtenue par extrusion à la température ambiante sous forme de bandes ou de petites plaquettes.Les poudres à double base, outre la nitrocellulose, contiennent un pourcentage important d’un autre constituant servant de gélatinisant (un nitrate organique liquide en général). Elles sont fabriquées:– par laminage et extrusion à chaud, généralement sous forme de brins tubulaires: poudres françaises (à la nitroglycérine), poudres allemandes RP 8 (à la nitroglycérine) et Digl RP 38 (au dinitrate de diéthylèneglycol...);– par laminage et calandrage à chaud, généralement sous forme de paillettes ou de plaquettes carrées: balistites classiques à la nitroglycérine, balistites allemandes au dinitrate de diéthylèneglycol...;– par coulage du liquide gélatinisant dans un moule équipé en fonction du but recherché (blocs pour autopropulsion) et rempli d’une poudre à simple base en petits grains; le liquide remplit les intervalles entre les grains, puis le bloc obtenu subit un traitement thermique (cuisson) à une température modérée: poudres coulées à double base.Les poudres multibases sont parfois considérées comme de simples variétés de poudres à double base, car elles renferment le plus souvent de la nitrocellulose et de la nitroglycérine: poudres allemandes et anglaises à la nitroguanidine.À l’exception des poudres destinées à l’autopropulsion (poudres coulées à double base notamment), qui se présentent sous la forme de blocs cylindriques, les poudres sans fumée ont l’aspect de fragments solides (grains sphériques, bâtonnets, perles, plaquettes, bandes, cordes, brins tubulaires), dont les dimensions sont adaptées aux calibres des armes à feu auxquelles ces poudres sont destinées.Propergols compositesEssentiellement réservés à l’autopropulsion, les propergols composites sont obtenus en mélangeant intimement un combustible et un comburant chimiquement distincts. Le combustible (asphalte, résine, caoutchouc naturel ou synthétique, résines thermoplastiques, thermodurcissables, thermopolymérisables...) sert en même temps de support et de liant pour le comburant (sel minéral oxygéné; nitrate ou perchlorate), qui, finement divisé, s’y trouve dispersé. Aux constituants principaux – comburant et combustible – on ajoute, généralement en faibles quantités, des ingrédients destinés à faciliter la fabrication (agents mouillants, comme la lécithine...), à améliorer la poudre terminée (plastifiants comme les esters d’alcool à grande masse moléculaire, durcisseurs comme le noir de carbone dans les poudres à base de caoutchouc naturel ou synthétique, antioxygènes...), ou encore à modifier les propriétés balistiques de celle-ci (catalyseurs de combustion, poudres métalliques...).Du fait de considérations de prix, de disponibilités, de facilité de mise en œuvre (élimination notamment de constituants trop sensibles, trop fragiles ou trop hygroscopiques, d’oxydants trop pauvres en oxygène...), le choix des comburants est pratiquement limité aux perchlorates de potassium ou d’ammonium, ainsi que, pour certains usages particuliers, au nitrate d’ammonium. Le choix des combustibles liants, beaucoup plus large, porte sur une très grande variété de substances, qui confèrent aux propergols les propriétés physiques et mécaniques requises: hydrocarbures à grande masse moléculaire (goudron, asphalte, caoutchouc naturel ou synthétique), matières plastiques (polyéthers, polyesters, phénoplastes, aminoplastes, polyuréthannes...).5. Caractéristiques des substances explosivesLes effets produits par la décomposition des substances explosives dépendent essentiellement, toutes choses égales par ailleurs, du volume gazeux dégagé, de la température des produits d’explosion et de la vitesse avec laquelle s’effectue la décomposition. Aussi la connaissance des caractéristiques thermochimiques et cinétiques de cette décomposition (grâce à une évaluation théorique ou à une détermination expérimentale) est-elle nécessaire pour juger des possibilités pratiques d’emploi et des performances à attendre des diverses substances explosives.Évaluations théoriquesPour les nombreuses substances explosives qui renferment du carbone, de l’hydrogène, de l’oxygène et de l’azote, la réaction globale de décomposition (l’explosion) correspond à une oxydation des éléments combustibles, carbone et hydrogène, par l’oxygène disponible dans la substance, et l’on peut alors distinguer celles qui sont suroxygénées ou à combustion complète, c’est-à-dire qui contiennent une quantité d’oxygène supérieure ou égale à celle qui permet la combustion complète du carbone et de l’hydrogène et celles qui sont sous-oxygénées. Celles-ci peuvent même renfermer une quantité d’oxygène insuffisante pour assurer leur gazéification complète, et il se produit un dépôt de carbone lors de leur combustion (substances surcarbonées).La décomposition de toutes ces substances explosives conduit à la formation, en dehors de l’azote, de quantités variables de dioxyde de carbone, d’oxyde de carbone, d’hydrogène et de vapeur d’eau, liées par l’équation réversible du «gaz à eau»:
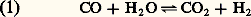 et, lorsque la substance explosive n’est pas entièrement gazéifiable, d’un dépôt de carbone conformément à l’équation réversible:
et, lorsque la substance explosive n’est pas entièrement gazéifiable, d’un dépôt de carbone conformément à l’équation réversible: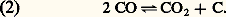 Le problème posé par l’explosion des autres substances explosives est évidemment plus complexe, mais on peut facilement montrer que, d’une manière générale, si l’on connaît la composition de la substance explosive, ses propriétés thermochimiques, ainsi que celles des produits de décomposition et les constantes d’équilibre entre ceux-ci, il est théoriquement possible de calculer la température d’explosion et d’obtenir les valeurs d’autres caractéristiques comme le volume spécifique d’explosion, volume des produits gazeux provenant de la décomposition de l’unité de masse de la substance, ou le potentiel réel, quantité de chaleur dégagée par cette unité de masse de la substance à la température d’explosion. La présence de produits de dissociation (OH, H, NO) à température élevée et sous pression relativement faible (inférieure à quelques dizaines d’atmosphères), ainsi que de produits secondaires de combinaison (NH3, CH4...) à température basse (face=F0019 麗 2 000 K), complique seulement les calculs dans certains cas en imposant de prendre en considération un nombre élevé de produits de décomposition.Étant donné les hautes pressions rencontrées dans les canons et a fortiori au cours des détonations, l’état non parfait des gaz oblige malheureusement à modifier les calculs en apportant des corrections aux données thermochimiques, aux chaleurs spécifiques et aux constantes d’équilibre. Leur évaluation exige la connaissance des équations d’état des produits en présence dans un domaine de températures et de pressions, qu’il n’est pas possible d’atteindre par une expérimentation directe. Dans ces conditions, on tend de plus en plus à adopter une équation d’état générale et à en déterminer les coefficients pour que les résultats des calculs reproduisent l’évolution de grandeurs mesurables comme la pression d’explosion des poudres en vase clos en fonction de la quantité de substance utilisée (loi de Noble et d’Abel) ou la vitesse de détonation en fonction de la densité de chargement de la cartouche d’explosif (théorie thermohydrodynamique de la détonation développée par Chapman et Jouguet).Déterminations expérimentalesDes installations calorimétriques permettent de déterminer au laboratoire les chaleurs de formation des substances explosives et de leurs constituants, ainsi que les potentiels apparents de ces substances, c’est-à-dire les quantités de chaleur qu’elles dégagent en brûlant dans un vase clos en l’absence d’oxygène, l’eau se trouvant à l’état liquide dans les produits de la combustion.Les bombes manométriques (tubes d’acier à parois épaisses, dont les extrémités filetées peuvent recevoir un bouchon destiné à la mise à feu et un bouchon comportant un dispositif d’enregistrement de la pression) rendent possible une étude approfondie de la déflagration des agents propulsifs. Grâce à elles:Henry Robertson Noble et Frederick Augustus Abel ont établi la loi qui relie la pression p développée en vase clos à deux caractéristiques thermodynamiques de la substance explosive, la force f (pression d’explosion, qui correspondrait à la décomposition de l’unité de poids de substance dans un récipient de volume égal à l’unité, si les produits gazeux d’explosion étaient parfaits) et le covolume 兀 (covolume de l’équation d’état de Van der Waals dans l’hypothèse où les forces de cohésion sont négligeables):
Le problème posé par l’explosion des autres substances explosives est évidemment plus complexe, mais on peut facilement montrer que, d’une manière générale, si l’on connaît la composition de la substance explosive, ses propriétés thermochimiques, ainsi que celles des produits de décomposition et les constantes d’équilibre entre ceux-ci, il est théoriquement possible de calculer la température d’explosion et d’obtenir les valeurs d’autres caractéristiques comme le volume spécifique d’explosion, volume des produits gazeux provenant de la décomposition de l’unité de masse de la substance, ou le potentiel réel, quantité de chaleur dégagée par cette unité de masse de la substance à la température d’explosion. La présence de produits de dissociation (OH, H, NO) à température élevée et sous pression relativement faible (inférieure à quelques dizaines d’atmosphères), ainsi que de produits secondaires de combinaison (NH3, CH4...) à température basse (face=F0019 麗 2 000 K), complique seulement les calculs dans certains cas en imposant de prendre en considération un nombre élevé de produits de décomposition.Étant donné les hautes pressions rencontrées dans les canons et a fortiori au cours des détonations, l’état non parfait des gaz oblige malheureusement à modifier les calculs en apportant des corrections aux données thermochimiques, aux chaleurs spécifiques et aux constantes d’équilibre. Leur évaluation exige la connaissance des équations d’état des produits en présence dans un domaine de températures et de pressions, qu’il n’est pas possible d’atteindre par une expérimentation directe. Dans ces conditions, on tend de plus en plus à adopter une équation d’état générale et à en déterminer les coefficients pour que les résultats des calculs reproduisent l’évolution de grandeurs mesurables comme la pression d’explosion des poudres en vase clos en fonction de la quantité de substance utilisée (loi de Noble et d’Abel) ou la vitesse de détonation en fonction de la densité de chargement de la cartouche d’explosif (théorie thermohydrodynamique de la détonation développée par Chapman et Jouguet).Déterminations expérimentalesDes installations calorimétriques permettent de déterminer au laboratoire les chaleurs de formation des substances explosives et de leurs constituants, ainsi que les potentiels apparents de ces substances, c’est-à-dire les quantités de chaleur qu’elles dégagent en brûlant dans un vase clos en l’absence d’oxygène, l’eau se trouvant à l’état liquide dans les produits de la combustion.Les bombes manométriques (tubes d’acier à parois épaisses, dont les extrémités filetées peuvent recevoir un bouchon destiné à la mise à feu et un bouchon comportant un dispositif d’enregistrement de la pression) rendent possible une étude approfondie de la déflagration des agents propulsifs. Grâce à elles:Henry Robertson Noble et Frederick Augustus Abel ont établi la loi qui relie la pression p développée en vase clos à deux caractéristiques thermodynamiques de la substance explosive, la force f (pression d’explosion, qui correspondrait à la décomposition de l’unité de poids de substance dans un récipient de volume égal à l’unité, si les produits gazeux d’explosion étaient parfaits) et le covolume 兀 (covolume de l’équation d’état de Van der Waals dans l’hypothèse où les forces de cohésion sont négligeables):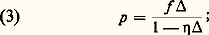 la densité de chargement étant le rapport de la masse de substance explosive au volume intérieur de la bombe.Paul Vieille a mis au point les premières poudres colloïdales et montré que leur combustion avait lieu par couches parallèles.De nombreux chercheurs (P. Vieille, Joseph Liouville, Muraour...) ont pu préciser les lois de combustion des poudres mises en service et notamment l’influence de la pression sur la vitesse de combustion; dans le domaine des pressions qui règnent dans les armes à feu, la vitesse linéaire de combustion est sensiblement une fonction linéaire de la pression:
la densité de chargement étant le rapport de la masse de substance explosive au volume intérieur de la bombe.Paul Vieille a mis au point les premières poudres colloïdales et montré que leur combustion avait lieu par couches parallèles.De nombreux chercheurs (P. Vieille, Joseph Liouville, Muraour...) ont pu préciser les lois de combustion des poudres mises en service et notamment l’influence de la pression sur la vitesse de combustion; dans le domaine des pressions qui règnent dans les armes à feu, la vitesse linéaire de combustion est sensiblement une fonction linéaire de la pression: L’étude de la combustion des substances explosives sous pression constante (pressions en général beaucoup plus faibles que celles qui sont constatées dans les bouches à feu) fait appel à des bombes à tuyères, dont la charge cylindrique brûle «en cigarette», ou à des chambres de pression, dites bombes de Crawford, où la matière introduite sous forme de brins de faible diamètre brûle dans une atmosphère inerte amenée à une pression p . Dans ce domaine des pressions, qui est celui des pressions dans les roquettes, la vitesse de combustion est sensiblement une fonction exponentielle de la pression:
L’étude de la combustion des substances explosives sous pression constante (pressions en général beaucoup plus faibles que celles qui sont constatées dans les bouches à feu) fait appel à des bombes à tuyères, dont la charge cylindrique brûle «en cigarette», ou à des chambres de pression, dites bombes de Crawford, où la matière introduite sous forme de brins de faible diamètre brûle dans une atmosphère inerte amenée à une pression p . Dans ce domaine des pressions, qui est celui des pressions dans les roquettes, la vitesse de combustion est sensiblement une fonction exponentielle de la pression: 見 étant en général nettement inférieur à 1.Dans le cas des détonations, la seule grandeur que l’on puisse mesurer expérimentalement avec une certaine précision est la vitesse D, qui constitue en fait le critère unique de validité des hypothèses sur lesquelles est fondée l’évaluation théorique des diverses caractéristiques des explosifs (et encore l’on a pu constater que plusieurs équations d’état différentes, tout en fournissant des vitesses de détonation identiques, conduisaient à des températures d’explosion très dissemblables). Le principe de cette mesure consiste à enregistrer les instants de passage de l’onde de détonation en deux points préalablement repérés et qui délimitent la base de mesure. Des constatations faites depuis Marcelin Berthelot et P. Vieille il ressort que la vitesse de détonation augmente avec le diamètre de la cartouche et avec la résistance de l’enveloppe de celle-ci jusqu’à une valeur maximale considérée comme «vitesse de détonation idéale». Pour des diamètres de cartouches décroissants, on observe des vitesses de détonation de plus en plus faibles jusqu’à ce que, au-dessous d’un certain «diamètre critique», la propagation d’une détonation en régime stable ne soit plus possible. Il semble en outre que, pour de nombreux explosifs de mine (explosifs nitratés surtout), la vitesse de détonation présente un maximum pour une certaine densité de chargement.Travail fourni par les substances explosivesLe travail maximal que peut théoriquement fournir une substance explosive se déduit tout naturellement de l’énergie qu’elle possède au moment de sa décomposition, c’est-à-dire de son potentiel réel, mais le travail effectif varie avec les conditions d’utilisation de l’énergie qu’elle a libérée et notamment avec la fraction de détente qui a été mise à profit. L’évaluation de ce travail réel et du rendement d’une substance explosive ne saurait donc résulter en toute rigueur que d’essais pratiqués à une échelle et dans des conditions très voisines de celles de l’emploi que l’on envisage. Mais, pour réduire le nombre des expériences coûteuses, on a imaginé des épreuves permettant de prévoir, dès le laboratoire, les performances des diverses substances explosives et de comparer leurs mérites dans les mêmes conditions d’utilisation. Pour les agents propulsifs, des épreuves à la bombe manométrique et à la bombe à tuyère fournissent d’excellents moyens de comparaison. Pour les explosifs, deux épreuves ont été plus ou moins normalisées: l’épreuve de brisance, qui permet de classer d’une manière satisfaisante les divers explosifs du point de vue de leurs effets destructeurs (évaluation de l’écrasement d’un cylindre provoqué par la détonation d’une cartouche de ces explosifs), et l’épreuve au bloc de plomb, imaginée par F. Abel vers 1877 et développée par le chimiste autrichien Trauzl (d’où le nom d’épreuve au bloc de Trauzl), qui consiste à faire détoner une charge d’explosif dans la cavité d’un bloc de plomb et à mesurer l’accroissement de volume de la cavité (la faveur dont jouit cette épreuve tient surtout à la corrélation simple qui existe entre le résultat de l’épreuve et le travail que l’explosif peut fournir pratiquement lors du tir soit pour l’abattage des roches, soit pour les travaux de déblaiement).6. Applications des substances explosivesPour «amorcer» les substances explosives, c’est-à-dire pour provoquer leur décomposition, il faut faire appel à diverses compositions pyrotechniques. Des mélanges à base de fulminate de mercure ou de trinitrorésorcinate de plomb chargent des amorces (inflammation par choc) ou des étoupilles (inflammation par frottement), qui doivent enflammer les agents propulsifs contenus dans des cartouches ou des gargousses; des poudres noires remplissant la partie centrale de tubes formés par l’entrecroisement régulier de fils de jute (mèches ou cordeaux Bickford) transmettent en général cet allumage; des compositions à base de fulminate de mercure ou d’azoture de plomb et d’acide picrique ou de tétryl, sous l’action d’un choc ou d’une inflammation (mèches ou allumage électrique), produisent une onde explosive capable d’entraîner la détonation des explosifs, au contact desquels le détonateur, qui les renferme, se trouve placé; la détonation est transmise par des cordeaux à la tolite, au tétryl, à la pentrite, etc., à enveloppe métallique ou plastique.Si on considère maintenant les emplois des substances explosives, en regroupant les applications qui font appel sensiblement aux mêmes caractéristiques, on peut distinguer: la propulsion de projectiles ou de roquettes ; la destruction et l’éclatement de projectiles ou de bombes; les utilisations dans les industries extractives, les travaux publics, l’agriculture et la recherche sismique. Les deux premiers groupes concernent surtout des buts militaires et le dernier des buts civils, bien qu’il soit fait appel, dans certaines utilisations militaires, à des compositions civiles et qu’il existe des applications civiles de la propulsion des projectiles (la chasse, par exemple) ou des roquettes (fusées de réjouissance, de sondage...).La propulsionSeules sont utilisables comme agents propulsifs les substances explosives (poudres) qui peuvent, dans les conditions d’emploi, brûler sans détoner.Dans les armes à feu, fusils ou canons, la poudre (en grains, en paillettes, en bandes, en tubes, etc.) est contenue dans une douille ou bien dans une ou plusieurs gargousses. La combustion, dont la durée dépend de l’épaisseur de la poudre et se chiffre en millièmes de seconde, fournit des produits gazeux, dont la détente est à l’origine de l’effet propulseur, mis à profit dans l’arme pour imprimer à un projectile une vitesse initiale allant de quelques centaines de mètres par seconde à 1 000, 1 200 ou même 1 500 m/s, cette vitesse permettant au projectile d’atteindre la portée demandée ou d’avoir un pouvoir perforant fixé à une certaine distance de la bouche de l’arme. L’étude de l’acquisition de cette vitesse et, d’une manière plus générale, du mouvement du projectile dans le canon relève de la balistique intérieure. Son but est, d’une part, d’étudier les moyens à mettre en œuvre pour faire acquérir aux projectiles les vitesses initiales cherchées, et, d’autre part, de déterminer les pressions correspondantes pour donner aux différentes parties du matériel la résistance convenable.Dans les roquettes à propergols solides (on laissera de côté les liquides, qu’on n’a pas l’habitude de ranger parmi les substances explosives), la poudre est contenue dans une partie de celles-ci – la chambre de combustion –, le plus souvent cylindrique et généralement en métal (en carton dans les fusées de réjouissance et les fusées paragrêles; en fil de verre bobiné dans certains missiles); la forme et l’épaisseur de cette poudre sont, pour une composition donnée, adaptées à l’évolution recherchée de l’effet propulseur de la roquette considérée. Cette adaptation de la poudre à la mission de la roquette et les améliorations que l’on peut apporter à la composition propulsive comme à l’engin sont essentiellement fondées sur des formules relativement simples, auxquelles conduit une étude balistique de l’autopropulsion. On améliore notamment les performances en augmentant les valeurs de deux paramètres, le rapport des masses (rapport des masses initiale et finale de l’engin) et l’impulsion spécifique de la poudre (poussée fournie par l’unité de masse d’agent propulsif).Applications militairesÀ l’exception des explosifs pour «fourneaux de mines», dont la nature et la mise en œuvre sont identiques à celles des explosifs employés dans les industries extractives, les explosifs militaires doivent être extrêmement brisants. Cela oblige à faire appel à des substances explosives qui détonent, et élimine, sauf peut-être pour les faibles puissances de rupture, les compositions déflagrantes. Lorsque les chargements explosifs sont soumis, lors de leur emploi, à des compressions brutales ou à des chocs, ou sont susceptibles d’être frappés par des projectiles (balles ou obus), il est en outre indispensable que les compositions retenues soient aussi peu sensibles que possible aux actions mécaniques. Comme cette insensibilité relative est également un élément important de la sécurité lors des fabrications, on s’efforce, même lorsque les conditions d’emploi ne l’exigent pas, de l’obtenir sans trop perdre de brisance en ajoutant un faible pourcentage de cire, de paraffine, etc.D’une manière générale, pour éviter une explosion prématurée de la charge, çelle-ci doit être compacte et telle que sa densité soit au moins égale à celle qui résulterait d’une compression violente par suite de phénomènes d’inertie. C’est pourquoi on utilise des chargements en explosifs fondus, en explosifs comprimés, en nougats (les fragments d’explosif solide sont enrobés par de l’explosif liquide), en semoule (explosif en partie fondu, en partie cristallisé), en explosif pâteux..., le type de chargement étant adapté à l’application envisagée: obus (de perforation, explosif, à schrapnells), torpilles, mines sous-marines, grenades sous-marines, bombes (de perforation, explosives...).Même lorsqu’il détone, un explosif peut être utilisé pour projeter un corps placé à son contact. Ce corps, généralement assimilable à une plaque métallique dans les applications, peut, suivant la direction d’arrivée du choc sur celle-ci, subir une projection frontale, latérale ou oblique. Pour un explosif et une densité de chargement donnés, la vitesse de la plaque est une fonction décroissante de la masse de celle-ci, alors que son énergie cinétique passe par un maximum, pour une valeur du rapport des masses de la plaque et de l’explosif, qui est fonction de l’angle de choc.Le phénomène de charge creuse, connu depuis les publications de Max von Forster en Allemagne (1883) et les travaux de Charles Edward Munroe aux États-Unis (1888), mais qui ne trouva que peu d’applications avant la Seconde Guerre mondiale, s’observe lorsqu’on aménage la forme géométrique de l’explosif de manière à faire converger les ondes de choc et à intensifier ainsi leurs effets dans une direction privilégiée. Le modèle le plus courant de charge creuse est constitué par un cylindre d’explosif, dans lequel a été ménagé un évidement conique portant un revêtement métallique mince, et qui est parcouru par une onde de détonation plane et perpendiculaire à son axe. Lorsque l’onde de détonation arrive sur le revêtement, celui-ci est projeté vers l’axe où il se divise en deux parties distinctes: le noyau, représentant la plus grande partie de la masse métallique et qui se déplace vers l’avant à une vitesse de quelques centaines de mètres par seconde, et le jet qui se déplace également vers l’avant mais à une vitesse de l’orde de 10 000 m/s. L’effet principal de la charge creuse est un effet de pénétration, qui est essentiellement dû au jet très rapide de métal. Le pouvoir de pénétration dépend de la nature du métal du revêtement, et ce sont les métaux les plus ductiles comme l’aluminium et surtout le cuivre qui produisent à grande distance les pénétrations les plus grandes.Applications industriellesOn se doute peu de la place considérable qu’occupent dans la vie moderne les explosifs industriels. Pour obtenir les métaux, le charbon, les matériaux de construction, il a fallu commencer par extraire du minerai, par abattre de la pierre dans la mine ou dans la carrière, et, pour cela, utiliser le plus souvent des explosifs. Les travaux publics, qu’il s’agisse de construire une route, un chemin de fer, un canal, un barrage, ou de percer un tunnel, d’aménager une chute d’eau ou une rivière pour la navigation, d’approfondir un port de mer, entraînent d’importantes consommations d’explosifs. Ceux-ci permettent de réduire les frais de main-d’œuvre et les délais d’exécution. L’agriculture elle-même fait appel aux explosifs, notamment pour la destruction des roches, l’arrachement des souches, la préparation des terrains de culture, le creusement de canaux d’irrigation ou de drainage, l’ameublissement du sol en vue de plantations. Les applications des explosifs industriels servent également à la recherche géologique par les procédés de prospection sismique a pris un développement considérable.Si l’on excepte les explosifs à l’oxygène liquide, très employés en France dans les mines de fer, et les poudres noires comprimées, pratiquement réservées à l’extraction de différents calcaires tendres, on peut dire que les besoins industriels sont sensiblement satisfaits pour moitié par les explosifs à base de nitroglycérine (dynamite) et pour moitié par les explosifs nitratés. Mais, suivant le but recherché, simple dislocation de gros blocs (carrières de pierre), division en morceaux de moyenne grosseur de la masse à abattre (extraction de minerais, de charbon, etc.) ou effets de broyage plus intense (destruction de rochers), et selon les conditions d’exploitation, on est amené à utiliser des explosifs différents du point de vue de leur puissance et de leur brisance. Il est en outre nécessaire de faire entrer en ligne de compte, pour choisir ces explosifs, non seulement des considérations de facilité d’emploi et d’économie, mais encore des considérations de sécurité, qui sont d’ailleurs à l’origine de réglementations très strictes établies par l’administration dans les divers domaines où l’on fait appel aux substances explosives.Pour obtenir le meilleur rendement de la puissance des explosifs en volume de matériaux abattus d’une paroi de mine, les explosifs sont utilisés sous forme de cartouches (plus rarement en vrac) introduites dans les cavités (trous de mine), qui sont ensuite closes aussi hermétiquement que possible par bourrage. Les cartouches ont une longueur de 10 à 20 cm et un diamètre de 18 à 40 mm, et, dans un trou de mine (dont la profondeur varie de 1 à 5 m), la longueur de la charge est en moyenne égale à la moitié et ne dépasse jamais les deux tiers de la longueur totale du trou. L’amorçage se fait au moyen d’un détonateur et d’une mèche, d’une amorce électrique ou d’un cordeau détonant, la cartouche amorcée étant placée obligatoirement en arrière (amorçage direct) ou en avant (amorçage postérieur) de la charge. Quant au bourrage, réalisé au sable fin, à l’argile humide ou même à l’eau, il augmente toujours, quand il est bien fait, le rendement de n’importe quel explosif.
見 étant en général nettement inférieur à 1.Dans le cas des détonations, la seule grandeur que l’on puisse mesurer expérimentalement avec une certaine précision est la vitesse D, qui constitue en fait le critère unique de validité des hypothèses sur lesquelles est fondée l’évaluation théorique des diverses caractéristiques des explosifs (et encore l’on a pu constater que plusieurs équations d’état différentes, tout en fournissant des vitesses de détonation identiques, conduisaient à des températures d’explosion très dissemblables). Le principe de cette mesure consiste à enregistrer les instants de passage de l’onde de détonation en deux points préalablement repérés et qui délimitent la base de mesure. Des constatations faites depuis Marcelin Berthelot et P. Vieille il ressort que la vitesse de détonation augmente avec le diamètre de la cartouche et avec la résistance de l’enveloppe de celle-ci jusqu’à une valeur maximale considérée comme «vitesse de détonation idéale». Pour des diamètres de cartouches décroissants, on observe des vitesses de détonation de plus en plus faibles jusqu’à ce que, au-dessous d’un certain «diamètre critique», la propagation d’une détonation en régime stable ne soit plus possible. Il semble en outre que, pour de nombreux explosifs de mine (explosifs nitratés surtout), la vitesse de détonation présente un maximum pour une certaine densité de chargement.Travail fourni par les substances explosivesLe travail maximal que peut théoriquement fournir une substance explosive se déduit tout naturellement de l’énergie qu’elle possède au moment de sa décomposition, c’est-à-dire de son potentiel réel, mais le travail effectif varie avec les conditions d’utilisation de l’énergie qu’elle a libérée et notamment avec la fraction de détente qui a été mise à profit. L’évaluation de ce travail réel et du rendement d’une substance explosive ne saurait donc résulter en toute rigueur que d’essais pratiqués à une échelle et dans des conditions très voisines de celles de l’emploi que l’on envisage. Mais, pour réduire le nombre des expériences coûteuses, on a imaginé des épreuves permettant de prévoir, dès le laboratoire, les performances des diverses substances explosives et de comparer leurs mérites dans les mêmes conditions d’utilisation. Pour les agents propulsifs, des épreuves à la bombe manométrique et à la bombe à tuyère fournissent d’excellents moyens de comparaison. Pour les explosifs, deux épreuves ont été plus ou moins normalisées: l’épreuve de brisance, qui permet de classer d’une manière satisfaisante les divers explosifs du point de vue de leurs effets destructeurs (évaluation de l’écrasement d’un cylindre provoqué par la détonation d’une cartouche de ces explosifs), et l’épreuve au bloc de plomb, imaginée par F. Abel vers 1877 et développée par le chimiste autrichien Trauzl (d’où le nom d’épreuve au bloc de Trauzl), qui consiste à faire détoner une charge d’explosif dans la cavité d’un bloc de plomb et à mesurer l’accroissement de volume de la cavité (la faveur dont jouit cette épreuve tient surtout à la corrélation simple qui existe entre le résultat de l’épreuve et le travail que l’explosif peut fournir pratiquement lors du tir soit pour l’abattage des roches, soit pour les travaux de déblaiement).6. Applications des substances explosivesPour «amorcer» les substances explosives, c’est-à-dire pour provoquer leur décomposition, il faut faire appel à diverses compositions pyrotechniques. Des mélanges à base de fulminate de mercure ou de trinitrorésorcinate de plomb chargent des amorces (inflammation par choc) ou des étoupilles (inflammation par frottement), qui doivent enflammer les agents propulsifs contenus dans des cartouches ou des gargousses; des poudres noires remplissant la partie centrale de tubes formés par l’entrecroisement régulier de fils de jute (mèches ou cordeaux Bickford) transmettent en général cet allumage; des compositions à base de fulminate de mercure ou d’azoture de plomb et d’acide picrique ou de tétryl, sous l’action d’un choc ou d’une inflammation (mèches ou allumage électrique), produisent une onde explosive capable d’entraîner la détonation des explosifs, au contact desquels le détonateur, qui les renferme, se trouve placé; la détonation est transmise par des cordeaux à la tolite, au tétryl, à la pentrite, etc., à enveloppe métallique ou plastique.Si on considère maintenant les emplois des substances explosives, en regroupant les applications qui font appel sensiblement aux mêmes caractéristiques, on peut distinguer: la propulsion de projectiles ou de roquettes ; la destruction et l’éclatement de projectiles ou de bombes; les utilisations dans les industries extractives, les travaux publics, l’agriculture et la recherche sismique. Les deux premiers groupes concernent surtout des buts militaires et le dernier des buts civils, bien qu’il soit fait appel, dans certaines utilisations militaires, à des compositions civiles et qu’il existe des applications civiles de la propulsion des projectiles (la chasse, par exemple) ou des roquettes (fusées de réjouissance, de sondage...).La propulsionSeules sont utilisables comme agents propulsifs les substances explosives (poudres) qui peuvent, dans les conditions d’emploi, brûler sans détoner.Dans les armes à feu, fusils ou canons, la poudre (en grains, en paillettes, en bandes, en tubes, etc.) est contenue dans une douille ou bien dans une ou plusieurs gargousses. La combustion, dont la durée dépend de l’épaisseur de la poudre et se chiffre en millièmes de seconde, fournit des produits gazeux, dont la détente est à l’origine de l’effet propulseur, mis à profit dans l’arme pour imprimer à un projectile une vitesse initiale allant de quelques centaines de mètres par seconde à 1 000, 1 200 ou même 1 500 m/s, cette vitesse permettant au projectile d’atteindre la portée demandée ou d’avoir un pouvoir perforant fixé à une certaine distance de la bouche de l’arme. L’étude de l’acquisition de cette vitesse et, d’une manière plus générale, du mouvement du projectile dans le canon relève de la balistique intérieure. Son but est, d’une part, d’étudier les moyens à mettre en œuvre pour faire acquérir aux projectiles les vitesses initiales cherchées, et, d’autre part, de déterminer les pressions correspondantes pour donner aux différentes parties du matériel la résistance convenable.Dans les roquettes à propergols solides (on laissera de côté les liquides, qu’on n’a pas l’habitude de ranger parmi les substances explosives), la poudre est contenue dans une partie de celles-ci – la chambre de combustion –, le plus souvent cylindrique et généralement en métal (en carton dans les fusées de réjouissance et les fusées paragrêles; en fil de verre bobiné dans certains missiles); la forme et l’épaisseur de cette poudre sont, pour une composition donnée, adaptées à l’évolution recherchée de l’effet propulseur de la roquette considérée. Cette adaptation de la poudre à la mission de la roquette et les améliorations que l’on peut apporter à la composition propulsive comme à l’engin sont essentiellement fondées sur des formules relativement simples, auxquelles conduit une étude balistique de l’autopropulsion. On améliore notamment les performances en augmentant les valeurs de deux paramètres, le rapport des masses (rapport des masses initiale et finale de l’engin) et l’impulsion spécifique de la poudre (poussée fournie par l’unité de masse d’agent propulsif).Applications militairesÀ l’exception des explosifs pour «fourneaux de mines», dont la nature et la mise en œuvre sont identiques à celles des explosifs employés dans les industries extractives, les explosifs militaires doivent être extrêmement brisants. Cela oblige à faire appel à des substances explosives qui détonent, et élimine, sauf peut-être pour les faibles puissances de rupture, les compositions déflagrantes. Lorsque les chargements explosifs sont soumis, lors de leur emploi, à des compressions brutales ou à des chocs, ou sont susceptibles d’être frappés par des projectiles (balles ou obus), il est en outre indispensable que les compositions retenues soient aussi peu sensibles que possible aux actions mécaniques. Comme cette insensibilité relative est également un élément important de la sécurité lors des fabrications, on s’efforce, même lorsque les conditions d’emploi ne l’exigent pas, de l’obtenir sans trop perdre de brisance en ajoutant un faible pourcentage de cire, de paraffine, etc.D’une manière générale, pour éviter une explosion prématurée de la charge, çelle-ci doit être compacte et telle que sa densité soit au moins égale à celle qui résulterait d’une compression violente par suite de phénomènes d’inertie. C’est pourquoi on utilise des chargements en explosifs fondus, en explosifs comprimés, en nougats (les fragments d’explosif solide sont enrobés par de l’explosif liquide), en semoule (explosif en partie fondu, en partie cristallisé), en explosif pâteux..., le type de chargement étant adapté à l’application envisagée: obus (de perforation, explosif, à schrapnells), torpilles, mines sous-marines, grenades sous-marines, bombes (de perforation, explosives...).Même lorsqu’il détone, un explosif peut être utilisé pour projeter un corps placé à son contact. Ce corps, généralement assimilable à une plaque métallique dans les applications, peut, suivant la direction d’arrivée du choc sur celle-ci, subir une projection frontale, latérale ou oblique. Pour un explosif et une densité de chargement donnés, la vitesse de la plaque est une fonction décroissante de la masse de celle-ci, alors que son énergie cinétique passe par un maximum, pour une valeur du rapport des masses de la plaque et de l’explosif, qui est fonction de l’angle de choc.Le phénomène de charge creuse, connu depuis les publications de Max von Forster en Allemagne (1883) et les travaux de Charles Edward Munroe aux États-Unis (1888), mais qui ne trouva que peu d’applications avant la Seconde Guerre mondiale, s’observe lorsqu’on aménage la forme géométrique de l’explosif de manière à faire converger les ondes de choc et à intensifier ainsi leurs effets dans une direction privilégiée. Le modèle le plus courant de charge creuse est constitué par un cylindre d’explosif, dans lequel a été ménagé un évidement conique portant un revêtement métallique mince, et qui est parcouru par une onde de détonation plane et perpendiculaire à son axe. Lorsque l’onde de détonation arrive sur le revêtement, celui-ci est projeté vers l’axe où il se divise en deux parties distinctes: le noyau, représentant la plus grande partie de la masse métallique et qui se déplace vers l’avant à une vitesse de quelques centaines de mètres par seconde, et le jet qui se déplace également vers l’avant mais à une vitesse de l’orde de 10 000 m/s. L’effet principal de la charge creuse est un effet de pénétration, qui est essentiellement dû au jet très rapide de métal. Le pouvoir de pénétration dépend de la nature du métal du revêtement, et ce sont les métaux les plus ductiles comme l’aluminium et surtout le cuivre qui produisent à grande distance les pénétrations les plus grandes.Applications industriellesOn se doute peu de la place considérable qu’occupent dans la vie moderne les explosifs industriels. Pour obtenir les métaux, le charbon, les matériaux de construction, il a fallu commencer par extraire du minerai, par abattre de la pierre dans la mine ou dans la carrière, et, pour cela, utiliser le plus souvent des explosifs. Les travaux publics, qu’il s’agisse de construire une route, un chemin de fer, un canal, un barrage, ou de percer un tunnel, d’aménager une chute d’eau ou une rivière pour la navigation, d’approfondir un port de mer, entraînent d’importantes consommations d’explosifs. Ceux-ci permettent de réduire les frais de main-d’œuvre et les délais d’exécution. L’agriculture elle-même fait appel aux explosifs, notamment pour la destruction des roches, l’arrachement des souches, la préparation des terrains de culture, le creusement de canaux d’irrigation ou de drainage, l’ameublissement du sol en vue de plantations. Les applications des explosifs industriels servent également à la recherche géologique par les procédés de prospection sismique a pris un développement considérable.Si l’on excepte les explosifs à l’oxygène liquide, très employés en France dans les mines de fer, et les poudres noires comprimées, pratiquement réservées à l’extraction de différents calcaires tendres, on peut dire que les besoins industriels sont sensiblement satisfaits pour moitié par les explosifs à base de nitroglycérine (dynamite) et pour moitié par les explosifs nitratés. Mais, suivant le but recherché, simple dislocation de gros blocs (carrières de pierre), division en morceaux de moyenne grosseur de la masse à abattre (extraction de minerais, de charbon, etc.) ou effets de broyage plus intense (destruction de rochers), et selon les conditions d’exploitation, on est amené à utiliser des explosifs différents du point de vue de leur puissance et de leur brisance. Il est en outre nécessaire de faire entrer en ligne de compte, pour choisir ces explosifs, non seulement des considérations de facilité d’emploi et d’économie, mais encore des considérations de sécurité, qui sont d’ailleurs à l’origine de réglementations très strictes établies par l’administration dans les divers domaines où l’on fait appel aux substances explosives.Pour obtenir le meilleur rendement de la puissance des explosifs en volume de matériaux abattus d’une paroi de mine, les explosifs sont utilisés sous forme de cartouches (plus rarement en vrac) introduites dans les cavités (trous de mine), qui sont ensuite closes aussi hermétiquement que possible par bourrage. Les cartouches ont une longueur de 10 à 20 cm et un diamètre de 18 à 40 mm, et, dans un trou de mine (dont la profondeur varie de 1 à 5 m), la longueur de la charge est en moyenne égale à la moitié et ne dépasse jamais les deux tiers de la longueur totale du trou. L’amorçage se fait au moyen d’un détonateur et d’une mèche, d’une amorce électrique ou d’un cordeau détonant, la cartouche amorcée étant placée obligatoirement en arrière (amorçage direct) ou en avant (amorçage postérieur) de la charge. Quant au bourrage, réalisé au sable fin, à l’argile humide ou même à l’eau, il augmente toujours, quand il est bien fait, le rendement de n’importe quel explosif.
Encyclopédie Universelle. 2012.
